Un implant biotechnologique pour relier le cerveau à une machine : c’est le projet que porte Elon Musk avec sa startup Neuralink, depuis plusieurs années. Après avoir conçu la puce au cœur de cette interface, ainsi qu’un robot chirurgical spécialement conçu pour cette implantation, l’entreprise est sur le point de franchir une nouvelle étape. Jusqu’à présent, les essais avaient exclusivement lieu chez des animaux. Les autorités de santé américaines ont finalement donné leur accord en mai 2023 : le prochain test se fera avec des humains. Cette approbation donnera lieu à un essai clinique de phase 1, avec des volontaires, afin de tester l’efficacité et la sécurité du dispositif.
Ce feu vert peut surprendre, tant Neuralink traîne de nombreuses casseroles et zones de flou. La situation des animaux, durant les premiers essais, est la première question qui se pose : pas moins de 1 500 animaux seraient morts, depuis 2018, lors des expérimentations. Des moutons, des singes, des cochons, des rongeurs. En cause, une pression excessive sur les employés, conduisant à d’importances erreurs humaines, notamment lors des chirurgies. Début 2023, une enquête était également ouverte envers Neuralink pour le transport illégal de pathogènes dangereux pour l’être humain.

Il est probable que Neuralink ait pu, malgré tout, présenter de bons résultats auprès de la FDA, qui aura donc évalué une balance bénéfices-risques favorable. Mais le questionnement demeure : comment un tel essai est validé et à quel point le danger pour les humains a-t-il été pris en compte ? L’interrogation peut même être poussée plus loin : étant donné les précédents chez les animaux, que se passerait-il si un volontaire venait à mourir durant un essai de Neuralink ?
Un tel essai clinique serait « inimaginable » en France
En France, « aucun essai chez un volontaire sain pouvant entraîner un risque mortel ne peut être autorisé, ce serait inimaginable », nous explique Hélène Espérou, responsable du pôle recherche clinique de l’Inserm. De fait, un haut taux de décès durant les essais chez les animaux pourrait constituer un obstacle majeur à la moindre approbation. Dans l’hexagone, l’autorisation d’essais cliniques chez l’humain incombe à l’ANSM — Agence nationale de sécurité du médicament et des produits de santé.
Elle étudie notamment le protocole mis en place, la pertinence scientifique et les résultats des tests précliniques. Des comités de protection des personnes (CPP) s’assurent quant à eux du début à la fin que ces essais ne présentent pas de danger. Aux États-Unis, c’est la FDA (Food and Drug Administration) qui donne son approbation.
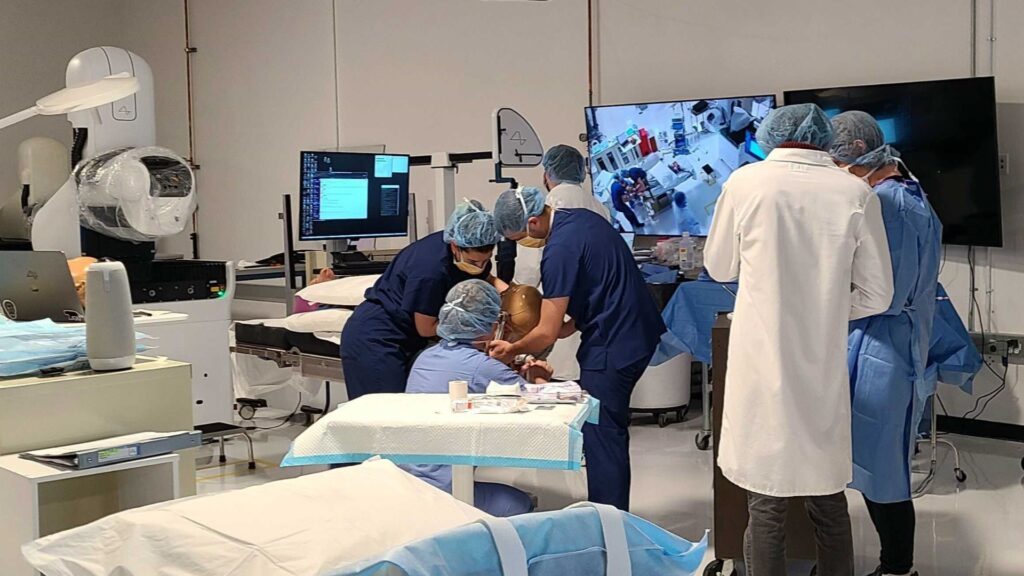
La vigilance des autorités de santé françaises a été d’autant plus renforcée depuis une affaire ayant eu lieu à Rennes, en 2016. Guillaume Molinet, 49 ans, est décédé cette année-là durant un essai clinique ayant eu lieu au centre de recherche Biotrial, afin de tester une nouvelle molécule. Après une plainte de la famille, une information judiciaire avait alors été ouverte, car, même si la molécule est identifiée comme cause de la mort, il s’agit de déterminer ce qui a pu provoquer un tel décès dans le protocole de recherche. D’autant plus que quatre autres volontaires en sont ressortis avec des séquelles. Sept ans après, l’instruction est toujours en cours.
Plusieurs scientifiques ont alerté sur le protocole de cette étude, dont les zones de flou comportait des risques — notamment puisque l’intervalle entre les administrations du médicament n’était pas précisé. Ce protocole avait pourtant été autorisé par l’ANSM. « Après cela, la réglementation française a été d’autant plus resserrée, avec aussi des inspections de l’ANSM durant les essais autorisés », note Hélène Espérou.
« La réglementation nord-américaine est moins soucieuse de la protection des personnes »
Aux États-Unis, la FDA procède également à une vérification du danger, lors de la phase d’approbation de l’essai. « La procédure protège les volontaires qui participent à des essais cliniques contre les risques déraisonnables et importants liés à ces essais », indique la FDA. La législation outre-Atlantique est toutefois « moins astringente qu’en France », relève Hélène Espérou, car « la réglementation nord américaine est moins soucieuse de la protection des personnes qu’en Europe et plus particulièrement qu’en France. »
Il s’agit, en grande partie, d’une différence culturelle. Par exemple, en France, il n’est pas possible de rémunérer à proprement parler les volontaires sains. Ces derniers sont indemnisés, pour le temps de travail perdu, les transports, là où, aux États-Unis, participer à un essai peut faire l’objet d’un véritable paiement. La différence culturelle se perçoit même en amont, estime Hélène Espérou : « Aucun chercheur ni aucune chercheuse ne proposerait un tel essai, car il y a une culture qui fait qu’ils ne franchiraient pas le pas de l’expérimentation clinique, s’il y a un décès chez l’animal. Et même s’ils déposaient un tel projet, ni l’ANSM ni les CPP ne l’autorisait et ils ne trouveraient pas de lieu pour le faire. »
Que se passerait-il, en cas de décès ?
Aux États-Unis comme en France, en cas de décès d’un patient durant un essai clinique, il s’agit de déterminer si la cause du décès incombe directement à l’essai ou non et, si oui, à quel aspect du protocole. Il y a une enquête de la part de l’autorité de santé, qui peut se doubler de l’ouverture d’une instruction judiciaire en cas de la plainte de la famille.
En 2016, sur le sol américain, plusieurs patients sont décédés lors d’un essai de Juno Therapeutics sur une nouvelle thérapie contre le cancer. La FDA a d’abord suspendu l’essai, avant de l’autoriser de nouveau à peine quelques jours plus tard. Les décès ont pourtant été reliés à l’essai clinique de Juno, pour une raison imprévue au protocole : le laboratoire a indiqué que le « coupable » était la fludarabine, un traitement de préparation à la chimiothérapie, pris en amont, et qui interagit dangereusement avec la thérapie nouvellement testée. La FDA a donc approuvé une reprise de l’essai, mais sans fludarabine.
Une porte-parole de la FDA avait affirmé que cette décision provenait de la « grande promesse » portée par cette thérapie contre le cancer, précisant que, dans tous les cas, l’agence sanitaire « examine constamment le profil risques-bénéfices des thérapies expérimentales et, lorsque nous sommes préoccupés par les risques, nous pouvons mettre les essais cliniques en pause.» Ces déclarations ne donnent toutefois pas de détails plus précis concernant la reprise de l’essai de Juno, ce qui peut s’expliquer par le caractère confidentiel (breveté) de certaines recherches dans le domaine médical.
« Il est essentiel que la FDA révise sa réglementation en matière de consentement éclairé »
L’affaire ne s’est toutefois pas arrêtée là. En 2017, le père de l’un des volontaires décédés s’est joint à une plainte plus vaste, menée contre la FDA par le Center for Responsible Science et trois participants à des essais cliniques. Cette plainte rapporte pas moins de 153 décès lors d’essais approuvés, rien qu’entre 2013 et 2017. Une situation préoccupante, selon cet organisme. « Il est essentiel que la FDA révise sa réglementation en matière de consentement éclairé afin d’accroître la protection de ces participants », demandaient les plaignants. Les volontaires devraient « être informés des différences de données entre l’expérimentation animale préclinique et l’expérimentation clinique sur des sujets humains », indique la plainte — restée sans suite.
Compte tenu des précédents récents, il est clair que si un patient humain venait à mourir durant les tests de Neuralink, sans cause naturelle/accidentelle extérieure évidente, l’essai se verrait donc suspendu. Une pause pendant laquelle la FDA évaluerait les raisons du décès. Il est difficile de savoir quelles pourraient en être les suites : si l’essai de Neuralink est la cause directe, l’essai pourrait mis en pause, comme pour celui de Juno, mais il est impossible de savoir si cette pause serait alors temporaire ou définitive. À l’image de l’affaire de Rennes, cependant, il faudra s’attendre à une importance médiatisation — plus retentissante encore étant donné l’aura d’Elon Musk.
+ rapide, + pratique, + exclusif
Zéro publicité, fonctions avancées de lecture, articles résumés par l'I.A, contenus exclusifs et plus encore.
Découvrez les nombreux avantages de Numerama+.
Vous avez lu 0 articles sur Numerama ce mois-ci
Tout le monde n'a pas les moyens de payer pour l'information.
C'est pourquoi nous maintenons notre journalisme ouvert à tous.
Mais si vous le pouvez,
voici trois bonnes raisons de soutenir notre travail :
- 1 Numerama+ contribue à offrir une expérience gratuite à tous les lecteurs de Numerama.
- 2 Vous profiterez d'une lecture sans publicité, de nombreuses fonctions avancées de lecture et des contenus exclusifs.
- 3 Aider Numerama dans sa mission : comprendre le présent pour anticiper l'avenir.
Si vous croyez en un web gratuit et à une information de qualité accessible au plus grand nombre, rejoignez Numerama+.
Toute l'actu tech en un clin d'œil
Ajoutez Numerama à votre écran d'accueil et restez connectés au futur !

Marre des réseaux sociaux ? Rejoignez la communauté Numerama sur WhatsApp !















