Les protéines composent les cellules vivantes en nourrissant certaines fonctionnalités. Chez les virus, ce sont les protéines qui leur permettent d’« attaquer » les cellules des hôtes, c’est-à-dire d’y pénétrer puis de s’y répliquer. C’est la raison pour laquelle la recherche scientifique s’intéresse de si près à la « protéine en forme de pointe » du nouveau coronavirus SARS-CoV-2 : c’est cette protéine qui lui permet de nous infecter, en s’attachant aux cellules des poumons. De fait, certains chercheurs pensent même qu’il y aurait, dans cette partie du coronavirus, la clé d’un vaccin.
Dans une étude parue le 30 mars 2020 dans Nature, les auteurs présentent les résultats de leur modélisation de la protéine. L’objectif de cette recherche était de comprendre comment le coronavirus s’accroche aux récepteurs dans notre organisme. « Une clé pour freiner cette épidémie est de comprendre le mécanisme de reconnaissance des récepteurs, ce qui régule son infectivité, sa pathogenèse, et le nombre d’hôtes », annoncent les chercheurs dès l’introduction du papier.
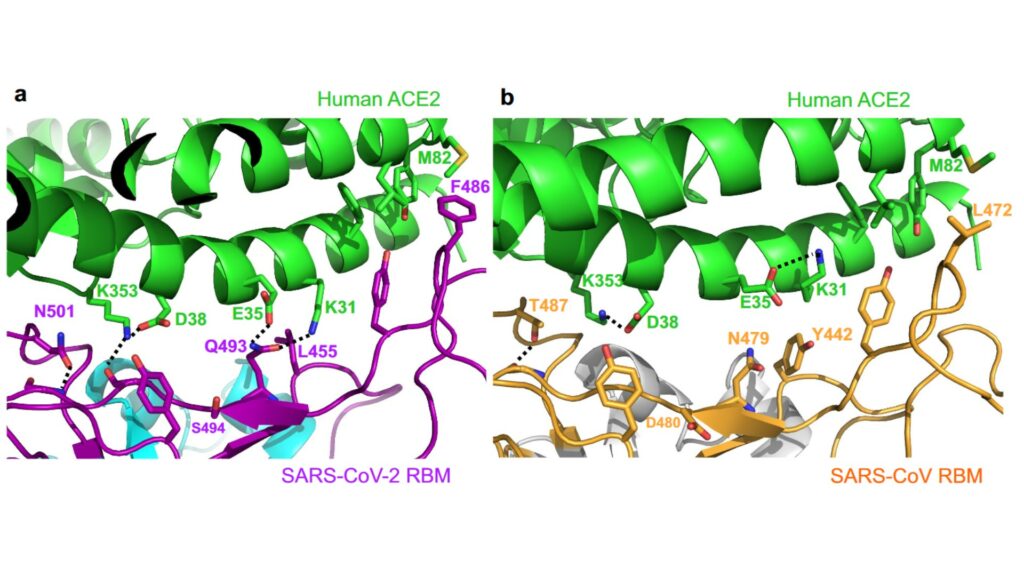
En haut, le récepteur dans les cellules humaines, en bas la protéine de coronavirus. À gauche, la liaison très compacte entre SARS-CoV-2 et le récepteur. À droite, on observe une liaison moins compacte entre l'ancien coronavirus et le récepteur.
Source : Nature
L’une des difficultés de la recherche scientifique autour de Covid-19 est que le coronavirus qui provoque cette maladie est à la fois connu et inconnu. Connu, car il appartient à la famille coronavirus dont nous connaissons déjà des caractéristiques. Inconnu, car il reste nouveau et obéit à des mécanismes que l’on ne comprend pas encore entièrement. Par exemple, SARS-CoV-2 et son prédécesseur et cousin SARS-CoV ont une similarité : ils reconnaissent et s’attachent au même type de récepteurs chez l’être humain, à savoir l’enzyme ACE2. Mais puisque SARS-CoV-2 se comporte différemment, il y a forcément un élément qui varie dans ce lien.
Une piste pour comprendre le coronavirus et trouver des traitements
Pour comprendre la singularité du nouveau coronavirus, les auteurs de cette étude, des scientifiques américains de l’université du Minnesota, ont procédé, par radiocristallographie, à une modélisation 3D à l’échelle atomique de la protéine du nouveau coronavirus ainsi que du récepteur, ACE2. Le résultat permet aux chercheurs d’observer, avec une certaine précision, les mutations des formes et des liaisons de la protéine au moment où elle s’attache aux récepteurs.
C’est ainsi qu’ils ont découvert que ces mutations ont tendance à former une sorte de « crête » très compacte au moment de la liaison. Et elle est bien plus compacte que pour le virus à l’origine du SRAS. Vous pouvez observer cette différence dans l’image d’illustration plus haut dans l’article : on y observe l’accroche plus « serrée » du nouveau coronavirus (cf.légende). Cela signifie que la protéine de SARS-CoV-2 lui permet de s’attacher bien plus solidement aux cellules humaines que son prédécesseur. Cela augmente son efficacité dans le mécanisme d’infection. Selon les auteurs de l’étude, cela pourrait donc expliquer pourquoi le nouveau coronavirus est autant infectieux et se propage si vite.
Autre avantage de cette nouvelle étude : plus on comprend le mécanisme par lequel le coronavirus s’attache aux cellules humaines, plus on peut potentiellement trouver des moyens pour bloquer ce processus. « Notre travail peut guider le développement d’anticorps monoclonaux qui agiraient comme un médicament pour reconnaître et neutraliser la partie de la protéine qui se lie au récepteur. Ou bien, une partie de la protéine pourrait devenir la base d’un vaccin », a précisé l’un des auteurs sur le site de l’université.
+ rapide, + pratique, + exclusif
Zéro publicité, fonctions avancées de lecture, articles résumés par l'I.A, contenus exclusifs et plus encore.
Découvrez les nombreux avantages de Numerama+.
Vous avez lu 0 articles sur Numerama ce mois-ci
Tout le monde n'a pas les moyens de payer pour l'information.
C'est pourquoi nous maintenons notre journalisme ouvert à tous.
Mais si vous le pouvez,
voici trois bonnes raisons de soutenir notre travail :
- 1 Numerama+ contribue à offrir une expérience gratuite à tous les lecteurs de Numerama.
- 2 Vous profiterez d'une lecture sans publicité, de nombreuses fonctions avancées de lecture et des contenus exclusifs.
- 3 Aider Numerama dans sa mission : comprendre le présent pour anticiper l'avenir.
Si vous croyez en un web gratuit et à une information de qualité accessible au plus grand nombre, rejoignez Numerama+.
Toute l'actu tech en un clin d'œil
Ajoutez Numerama à votre écran d'accueil et restez connectés au futur !

Marre des réseaux sociaux ? Rejoignez la communauté Numerama sur WhatsApp !

















